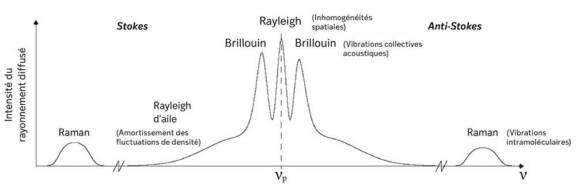
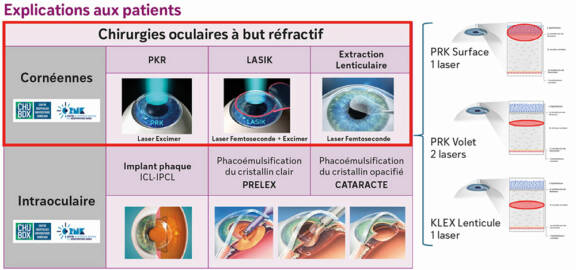
Explorations de la niche limbique
Le déficit en cellules souches limbiques (DCSL) est l’expression d’un double processus : une régénération insuffisante de l’épithélium de la cornée, ne pouvant assurer son maintien physiologique (homéostasie), associée à une invasion cornéenne par une prolifération conjonctivale. Il peut être dû à des étiologies variées résultant d’une diminution du nombre de cellules souches limbiques ou d’une anomalie de leur fonction.