Implant de corticoïde à longue durée d’action : repenser notre pratique dans l’OMD
Symposium Horus, Congrès LOR 2023
Pourquoi, quand et comment utiliser l’implant de corticoïde à longue durée d’action d’acétonide de fluocinolone (FAci) ?
D’après l’intervention du Pr Laurent Kodjikian
L’implant d’acétonide de fluocinolone (FAci) est autorisé en Europe depuis 2012 et aux États-Unis depuis 2014. Il n’est remboursé en France que depuis 2019. Il est indiqué en Europe dans le traitement de la baisse d’acuité visuelle (BAV) associée à l’œdème maculaire diabétique (OMD) chronique avec réponse insuffisante aux autres traitements. Indiqué chez nous en deuxième ou troisième intention, il peut être prescrit en première intention aux États-Unis en l’absence d’hypertonie oculaire (HTO) cortisonique. En 2019, le FAci obtient une extension d’autorisation de mise sur le marché (AMM) pour la prévention de la rechute d’uvéite non infectieuse affectant le segment postérieur de l’œil et il est remboursé dans cette indication depuis septembre 2022. Il s’agit d’un implant non biodégradable de 3,5 x 0,37 mm, contenant 190 microgrammes d’acétonide de fluocinolone et permettant la libération journalière continue de corticoïdes directement dans le corps vitré pendant une durée allant jusqu’à environ 36 mois.
Deux types d’implants à libération prolongée de corticostéroïdes sont disponibles : l’implant intravitréen de dexaméthasone (DEXi), qui libère rapidement d’importantes quantités de corticoïdes mais dont la concentration diminue après 4 mois, et le FAci, délivrant moins de corticoïdes mais de manière prolongée.
Le concept d’utilisation du FAci dans l’OMD peut être assimilé à celui du traitement de la migraine, distinguant le traitement de la « crise » du traitement de « fond ». Si le traitement de la crise migraineuse a pour but de réduire rapidement la douleur, le DEXi permet un assèchement rapide d’un volumineux œdème rétinien. De la même manière, un traitement « de fond » diminue la fréquence et l’intensité des crises et améliore la qualité de vie en réduisant le recours aux traitements additionnels. Le FAci, en raison de son efficacité prolongée (jusqu’à 36 mois), s’inscrit dans cette utilisation en prévenant et en atténuant les récidives œdémateuses, réduisant ainsi le recours à des traitements additionnels « de crise ». Il peut être utilisé seul dans les cas de petites récidives d’OMD. Une autre alternative est d’injecter le FAci dans le mois suivant une injection intravitréenne (IVT) de DEXi, le temps que le FAci commence à agir, étant donné son délai d’action plus retardé. Dans tous les cas, un suivi trimestriel est obligatoire. Devant une mauvaise réponse au DEXi, une recherche de facteurs favorisants locaux et systémiques est entreprise (angiographie ou ICG à la recherche de macroanévrysmes, facteurs de risque systémiques non contrôlés). La gestion des récidives sous FAci dépend du temps écoulé depuis son injection. Si une récidive survient avant 2 ans, un traitement de la « crise » par DEXi ou anti-VEGF est préconisé, sans signifier pour autant une inefficacité du FAci. Après 2 ans, une réinjection de FAci peut être envisagée. De même, tout événement prévisible sous FAci (ex. : chirurgie de la cataracte) peut être couvert par une IVT préventive de DEXi ou d’anti-VEGF. Enfin, l’efficacité du FAci n’est pas optimale chez les patients ne répondant pas anatomiquement au DEXi. L’algorithme décisionnel publié en 2022 par le Pr Kodjikian dans l’European Journal of Ophthalmology formalise cette approche.
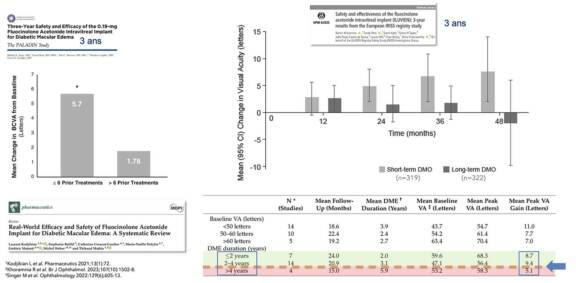
En vraie vie, les études observationnelles indiquent un gain visuel plus important sous DEXi et sous FAci qu’avec les anti-VEGF dans l’OMD. Ces résultats doivent cependant être interprétés avec prudence du fait de la sous-utilisation des anti-VEGF en pratique courante. Il a été démontré – Khoramnia R et al., Br J Ophthalmol 2023, Kodjikian L et al., Pharmaceutics 2021;13:72 ; Singer M et al. Ophthalmology. 2022;129(6):605- 13 – qu’un switch de DEXi vers FAci précoce (avant 6 IVT ou avec un OMD plus récent de moins de 4 ans de traitement) permettait d’obtenir de meilleurs résultats sur le plan de l’AV. Il a été démontré aussi (Eaton A et al. Ophthalmol Ther. 2019 Mar;8(1):52-62) que le recours à des traitements additionnels sera d’autant moindre que l’AV initiale est élevée (figure 1).
Ainsi, il est recommandé de ne pas attendre la chronicisation d’un OMD avant d’injecter le FAci, afin d’optimiser l’efficacité anatomique et fonctionnelle. La stabilité anatomique de la rétine s’obtient entre 6 et 9 mois et se maintient jusqu’à 3 ans, avec, comme facteurs de bon pronostic, une AV initiale élevée, une épaisseur centrale rétinienne basse et un OMD récent. Le FAci doit être présenté au patient comme un traitement de fond préventif à moyen et à long terme des récidives d’OMD. Les principaux objectifs de cet implant à libération prolongée sont la réduction du fardeau thérapeutique et la réduction des fluctuations anatomiques résultant des récidives de l’œdème. Les éventuelles récidives d’OMD sous FAci doivent être relativisées comme n’étant pas un signe d’inefficacité du traitement. Environ un tiers des patients nécessiteront un traitement additionnel sous FAci avant 3 ans, mais plus espacé et moins fréquent pour une amélioration de leur qualité de vie.
Implant FAc dans l’OMD : quels résultats en vraie vie à long terme ?
D’après l’intervention du Pr Aude Couturier
Efficacité
Les études de vraie vie montrent un gain visuel moyen de 8 lettres à 36 mois. Une étude anglaise présentée à l’ARVO en 2023 révèle qu’au cours du suivi de 6 ans, 75% des patients injectés par FAci maintiennent ou améliorent leur AV sans HTO surajoutée. En vraie vie, 2 avantages principaux sont recherchés avec le FAci : l’allègement du fardeau thérapeutique et la réduction des fluctuations d’épaisseur rétinienne. En moyenne, 2 patients sur 3 n’auront besoin d’aucun traitement additionnel pendant leur suivi. Chez un tiers des patients qui en auront besoin, un espacement significatif des injections d’environ 70% est observé, permettant une amélioration de la qualité de vie des patients. Le recours à des traitements additionnels étant favorisé par une épaisseur centrale rétinienne élevée à baseline et par une absence de photocoagulation panrétinienne (PPR).
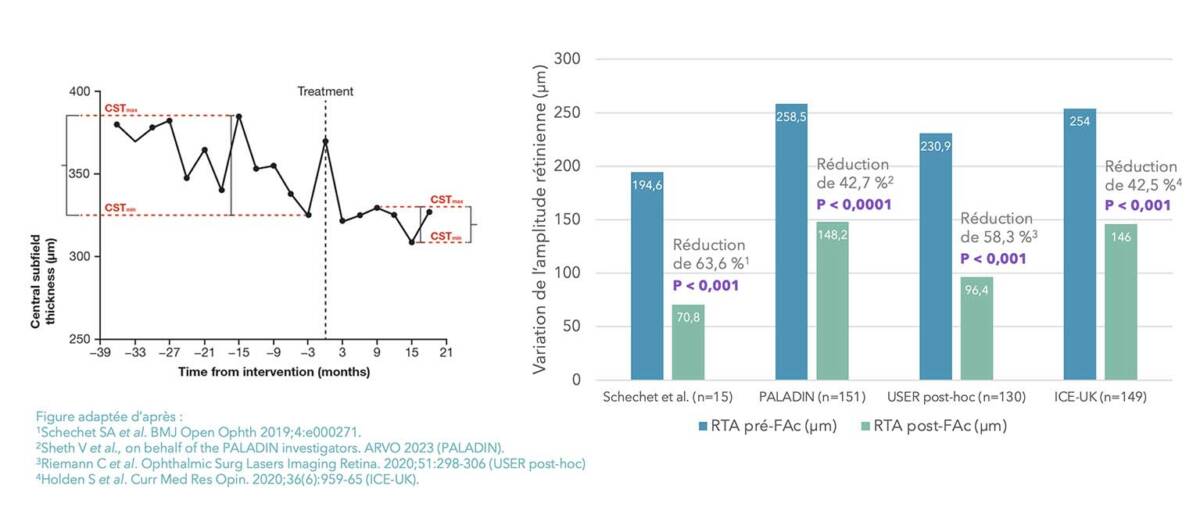
Contrairement aux variations d’amplitude de l’épaisseur rétinienne en « dents de scie » sous DEXi en cas de réinjections trop tardives, les fluctuations d’épaisseur rétinienne sous FAci sont réduites, permettant le maintien de l’intégrité des tissus et la préservation de l’AV finale, tributaire cependant de l’ancienneté de l’œdème, et de la destruction des couches externes (figure 2).
Tolérance
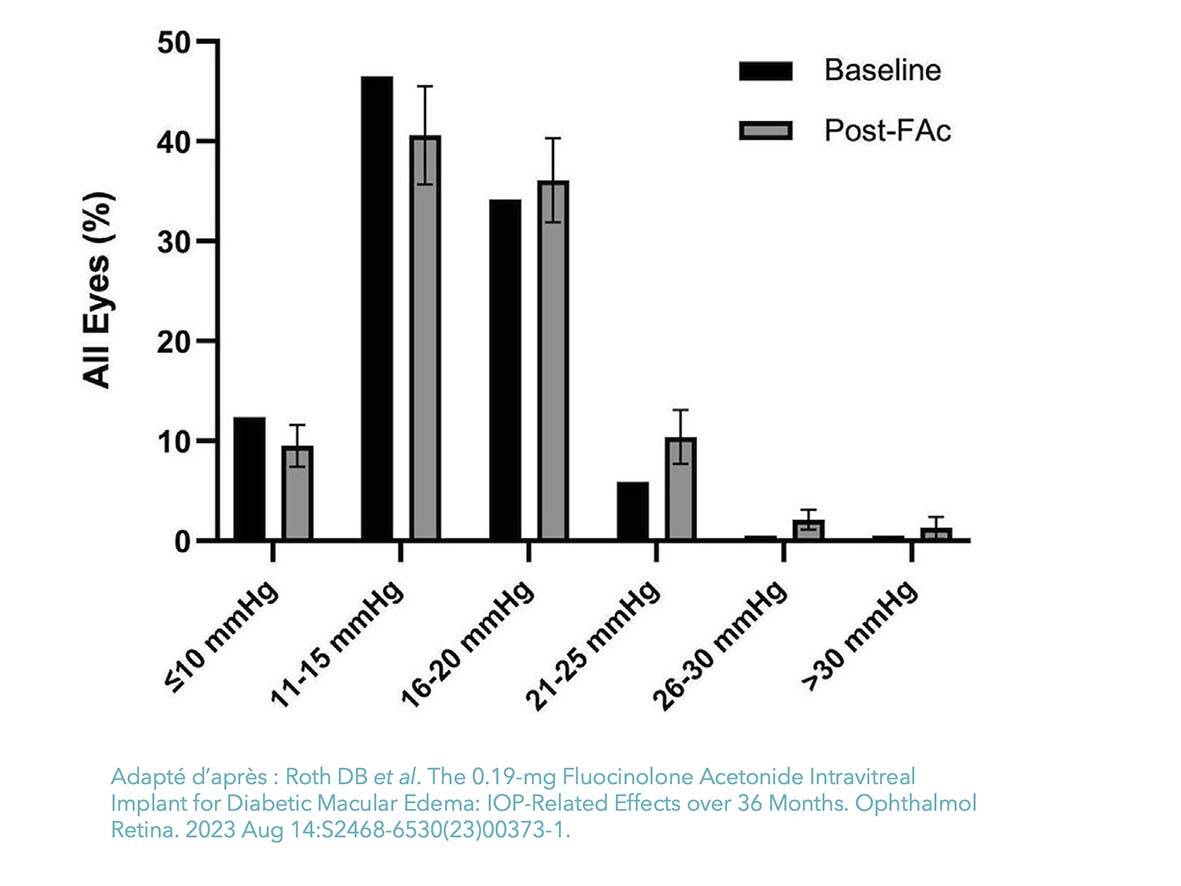
Le pic d’HTO sous FAci survient vers le neuvième mois. En vraie vie, certains patients injectés par FAci n’ont pas bénéficié d’IVT préalables de DEXi, bien que cela soit recommandé pour identifier les 20 à 30% de patients cortico-répondeurs. Après 2 ou 3 IVT de DEXi sans élévation de la pression intraoculaire (PIO), 85 à 90% des non-répondeurs aux corticoïdes conserveront le même profil de réponse pressionnelle sous FAci. Ces HTO cortisoniques sont généralement transitoires et le plus souvent bien maîtrisées par des collyres hypotonisants, avec un taux de chirurgie filtrante inférieur à 2% (figure 3).
Devenir à long terme
Une étude sur 10 ans réalisée (résultats non publiés) à l’hôpital Lariboisière (2014-2023, 17 patients) montre que pour un OMD chronique (5,9 années) à baseline, une IVT de FAci a permis une amélioration ou une stabilité de l’AV, accompagnée d’un assèchement significatif de l’épaisseur rétinienne centrale sur 3 ans (réduction de 648 à 376 µm la première année), persistant au-delà de 5 ans. Le nombre de traitements additionnels a augmenté avec le temps (2 sur 2 ans, 3,5 entre 1 et 3 ans, 4,7 entre 4 et 6 ans) et la tolérance pressionnelle était bonne.
Ainsi, les études de vraie vie et à long terme confirment l’allègement du fardeau thérapeutique et la réduction des fluctuations anatomiques rétiniennes. Deux à 3 IVT de DEXi préalables à celle du FAci sont recommandées pour minimiser le risque d’HTO cortisonique au cours du suivi sans retarder le switch.
Comment être plus sûr avec les corticoïdes en OMD ?
D’après l’intervention du Pr Corinne Dot
Le Pr Dot propose une check-list en 10 points afin de guider une utilisation plus sûre du FAci dans le traitement de l’OMD.
Connaître le statut de la PIO du patient
La PIO à l’inclusion doit être connue avant toute injection d’implant de corticoïde. Si la PIO est supérieure à 20 mmHg, une confirmation par aplanation est nécessaire car une fausse PIO en mode pulsé est observée chez environ 30% des patients. Des antécédents de glaucome à angle ouvert (GAO), d’HTO chronique ou de traitements hypotonisants doivent être recherchés. Tout doute nécessite l’examen de la papille et la mesure de la couche des fibres nerveuses rétiniennes ou RNFL (Retinal Nerve Fiber Layer) pour exclure une pathologie glaucomateuse contre-indiquant l’utilisation d’un implant de corticoïde tant que le bilan de cette affection n’est pas réalisé.
Respecter les indications et recommandations
Pour sa prescription, il est essentiel de se conformer aux indications prévues par l’AMM. Son utilisation doit respecter les recommandations de la Société française d’ophtalmologie (SFO) et de la Société française du glaucome (SFG) éditées en 2017 et réactualisées en 2023.
Utiliser en deuxième ou troisième intention
Dans l’OMD, l’utilisation de FAci en deuxième ou troisième intention doit permettre la prévention des récidives des œdèmes maculaires. Il peut ainsi être prescrit comme traitement de fond.
Effectuer un test thérapeutique aux corticoïdes
Pour un patient traité par IVT d’anti-VEGF et envisageant un switch vers le FAci, un test thérapeutique aux corticoïdes par DEXi est recommandé, de même qu’une mesure de la PIO à l’inclusion, une recherche d’HTO chronique et de GAO. Ce test permet d’évaluer la réponse anatomique et fonctionnelle ainsi que la tolérance de la PIO aux corticoïdes. Le switch vers le FAci peut être envisagé devant une réponse anatomique sous DEXi, avec un bon profil de sécurité pressionnelle obtenu après 2 ou 3 IVT de DEXi, conformément aux recommandations SFG/SFO de 2023. Si la PIO est supérieure à 25 mmHg, il n’est pas recommandé d’injecter FAci, sauf cas particulier et sous couvert d’un avis spécialisé en glaucome. L’IVT de FAci est contre-indiquée pour les hauts répondeurs corticoïdes (PIO supérieure à 30 mmHg).
Surveillance trimestrielle de la PIO
Le contrôle pressionnel trimestriel est obligatoire sous FAci. Environ un tiers des patients est cortico-répondeur et malgré le test thérapeutique aux corticoïdes, 20% des patients sont diagnostiqués répondeurs « tardifs », c’est-à-dire présentant une HTO après 3 IVT de DEXi, leur profil étant essentiellement celui de répondeurs faibles à modérés (Billant et al., 2023).
Sous FAci, l’analyse post-hoc de l’étude FAME retrouve une HTO à 1 ou 2 ans post-IVT pour 1 patient sur 3.
Pas de surrisque pour la double induction DEXi / FAci
La double induction de corticoïdes avec un DEXi suivi d’un FAci n’entraîne pas de surrisque d’HTO cortisonique, comme l’a démontré l’étude du CFSR du Pr Baillif en 2022, avec une double induction DEXi suivie de FAci inférieure à 2 mois, sans surrisque d’HTO rapporté par rapport à des injections plus espacées.
En cas d’HTO, traiter avec des collyres hypotonisants au long cours / FAci
La détection d’une HTO sous FAci nécessite l’introduction d’un traitement hypotonisant au long cours. Ce dernier devra être adapté à la réduction pressionnelle escomptée en utilisant soit une monothérapie (-30% pour les prostaglandines, -25% pour les bêtabloquants et les alpha-2-agonistes et -20% pour les inhibiteurs de l’anhydrase carbonique), soit d’emblée une bithérapie (-35 à -38% de réduction de PIO à baseline). Parmi eux, les prostaglandines bénéficient de la meilleure observance. Les prostaglandines peuvent être utilisées à condition qu’il n’y ait pas d’aggravation de l’œdème maculaire préexistant.
Intégrer le SLT dans l’arsenal thérapeutique hypotonisant
Depuis 2023, le SLT (Trabéculoplastie Sélective au Laser) fait partie des options thérapeutiques disponibles dans le nouvel algorithme de prise en charge de l’HTO. Il atténue les pics d’HTO lors des réinjections de DEXi (-35%), réduit le nombre de traitements hypotonisants nécessaires (-0,6 traitement) et permet d’envisager d’éventuelles réinjections de corticoïdes. Ce SLT « prophylactique » se réalise sur 180° et peut être renouvelé.
Le sujet GAO reste un patient particulier à risque
Les patients glaucomateux exigent une approche prudente car les données d’études randomisées dans cette population font encore défaut. Récemment, une étude de vraie vie comportant 11% de patients GAO à baseline injectés par FACi a permis d’estimer une élévation du risque d’HTO multiplié par 6 à 1 an en cas de traitement par monothérapie hypotonisante à baseline. Il convient donc d’éviter l’injection de FAci chez ces patients jusqu’à l’obtention de données plus spécifiques.
Continuer à suivre le fond d’œil et optimiser l’adhérence
Le suivi régulier du fond d’œil est essentiel, de même que le maintien de l’adhérence du patient aux contrôles, car une amélioration durable de l’état visuel pourrait conduire ce dernier à une moindre assiduité.