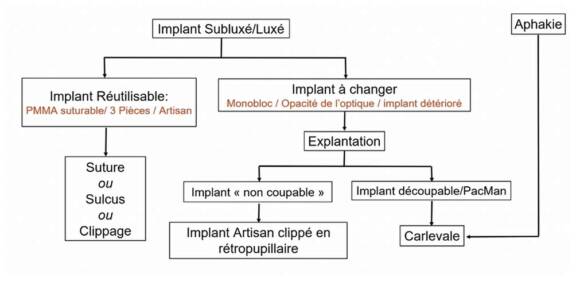
Que faire quand un œdème maculaire diabétique résiste aux IVT ?
Il n’existe actuellement aucun consensus concernant la prise en charge des patients dont l’œdème maculaire diabétique (OMD) résiste (non répondeurs ou répondeurs partiels) aux traitements injectés par voie intravitréenne (IVT). De nombreuses études, principalement rétrospectives, ont étudié les changements de traitement (switchs) mais il n’y a actuellement aucune étude randomisée disponible dans la littérature.